|
656010, Алтайский край, город Барнаул,
ул.Эмилии Алексеевой, 53 корпус 1,39 корпус2
Телефон / Факс: +7 (3852) 22-62-77
[email protected]
|
Предимплантационный скрининг что этоЭКО: ПГД или ПГС? | Об ЭКОКогда пара с бесплодием приходит к врачу ее интересует множество вопросов. В процессе беседы может прозвучать аббревиатура ПГД. Что это такое, для чего используется, нужно ли это именно в конкретном случае и что это даст? 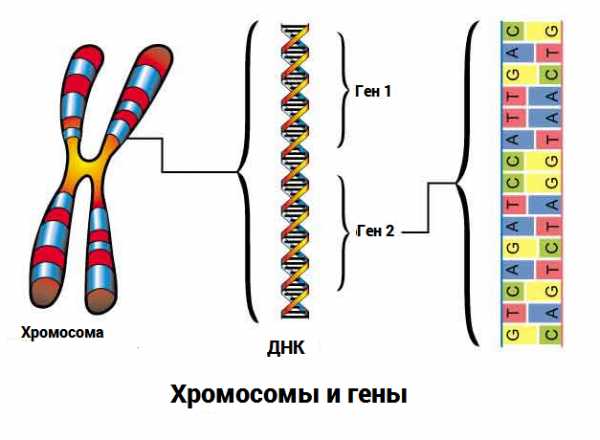 Рисунок 1 Хромосомы и гены. Хромосомы — это «упакованные гены». Каждая хромосома содержит огромное количество генов. Хромосом всего 46 (23 пары). Каждые ген «закодирован» определенной последовательностью нуклеиновых кислот Рисунок 1 Хромосомы и гены. Хромосомы — это «упакованные гены». Каждая хромосома содержит огромное количество генов. Хромосом всего 46 (23 пары). Каждые ген «закодирован» определенной последовательностью нуклеиновых кислот
Преимплантационная генетическая диагностика (ПГД)Преимплантационная генетическая диагностика — это метод, используемый для выявления генетических дефектов у эмбрионов, полученных с помощью экстракорпорального оплодотворения (ЭКО). Преимплантационная генетическая диагностика (ПГД) используется в случаях, когда один или оба генетических родителей имеют известную генетическую аномалию. В этом случае изучается эмбрион с целью выявления этой родительской аномалии. В основном это так называемые моногенные заболевания. Т.е. заболевание связано с одним геном, а не с несколькими. Одно из самых часто встречающихся моногенных заболевании — это муковисцидоз (нарушение функций органов дыхания), носителем является 2-5% населения. Чтобы заболевание проявилось необходимо чтобы встретились два носителя, при этом вероятность, что ребенок будет носителем — 50%, вероятность рождения больного, как и здорового ребенка составит — 25%. Частота рождения детей с муковисцидозом в России 1:10000. 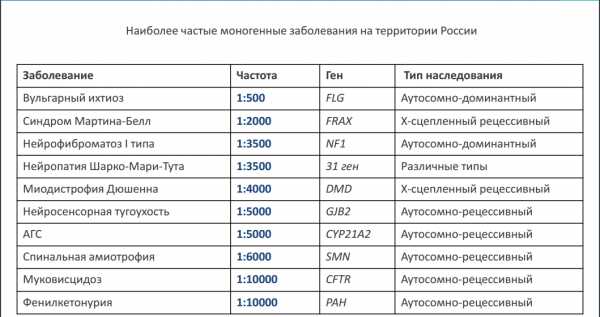 Рисунок 2 По данным ОАО «Институт Стволовых Клеток Человека» http://www.rahr.ru/d_pech_mat_konf/schevchenko.pdf Рисунок 2 По данным ОАО «Институт Стволовых Клеток Человека» http://www.rahr.ru/d_pech_mat_konf/schevchenko.pdf
Преимплантационная генетическая диагностика как раз и позволяет диагностировать заболевание у эмбриона еще до того, как его перенесут в полость матки. Проводить преимплантационную генетическую диагностику всем подряд нет смысла. Это оправдано только в случае если известно, что родители либо болеют, либо являются носителями моногенного заболевания. Таким образом, потребность в преимплантационной генетической диагностике очень маленькая и проводится не у пар, страдающих бесплодием, а у пар, где есть носительство или наличие моногенного заболевания. На консультации по бесплодию речь идет о преимплантационном генетическом скрининге (ПГС), а не о ПГД. Просто как-то традиционно сложилось что ПГС называют ПГД.
Преимплантационный генетический скрининг (ПГС)Преимплантационный генетический скрининг (ПГС) выполняется в случаях, когда эмбрионы от родителей с предположительно нормальным кариотипом (набором хромосом) изучаются на наличие анеуплоидии, т.е. нарушений набора хромосом. Самая частая хромосомная аномалия — трисомия по 21 паре, проявляется она в виде синдрома Дауна. 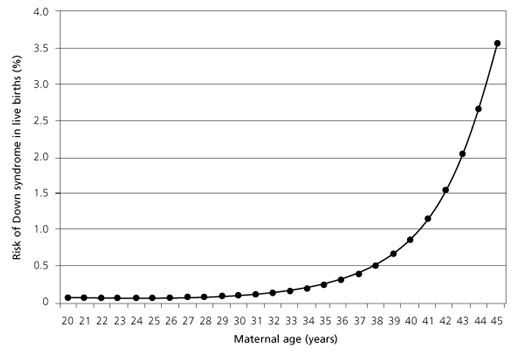 Рисунок 3 Риск рождения ребенка с синдромом Дауна в зависимости от возраста матери. NEWBERGER D. Down Syndrome: Prenatal Risk Assessment and Diagnosis. Am Fam Physician. 2000 Aug 15;62(4):825-832. Рисунок 3 Риск рождения ребенка с синдромом Дауна в зависимости от возраста матери. NEWBERGER D. Down Syndrome: Prenatal Risk Assessment and Diagnosis. Am Fam Physician. 2000 Aug 15;62(4):825-832.
Риск всех хромосомных аномалий растет при увеличении возраста женщины. Поскольку только эмбрионы с отсутствием известной патологии переносят в полость матки, преимплантационная диагностика является альтернативой диагностическим процедурам, проводимым с той же целью, но уже во время беременности (амниоцентез или биопсия хориона). При получении неудовлетворительных результатов после проведения биопсии хориона или амниоцентеза приходится принимать нелегкое решение о прерывании беременности.
В настоящее время ПГД и ПГС — это единственные доступные способы предотвращения зачатия ребенка, страдающего генетическим заболеванием. Огромный плюс этих методик, это отсутствие дилеммы прерывания уже наступившей беременности. Вся информация получается еще до наступления беременности.
Показания к преимплантационному генетическому скринингу (ПГС).
В настоящее время не существует конкретного перечня показаний для преимплантационного генетического скрининга (ПГС). Самые ранние потери беременности связаны преимущественно с анеуплоидиями. Поскольку после ПГС, в полость матки переносят только эмбрионы с нормальным кариотипом, риск выкидышей заметно снижается.
Как правило, проведения ПГС рекомендуется в следующих группах:
У пациентов этих групп высокий риск неудачи при ЭКО из-за высокой вероятности наличия анеуплоидных эмбрионов. ПГС уменьшает этот риск, т.к. в полость матки переносят только эмбрионы с нормальным кариотипом, имеющие более высокий шанс имплантации.
Возраст женщины.
Риск анеуплоидии у детей возрастает по мере увеличения возраста женщин. Способность яйцеклетки давать нормальный эмбрион с возрастом теряется. Особенно значимо риск начинает увеличиваться после 35 лет.
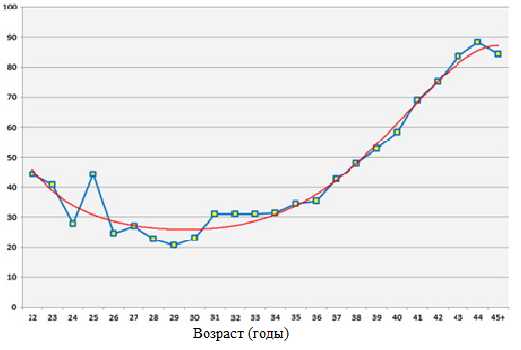 Рисунок 4 Зависимость между возрастом матери и долей эмбрионов с хромосомными аномалиями. Рисунок 4 Зависимость между возрастом матери и долей эмбрионов с хромосомными аномалиями.
Проведение ПГС у женщин старше 35 лет, увеличивает шанс на успешное ЭКО и, более того, резко снижает вероятность выкидышей. Собственно, шансы эмбриона с нормальным кариотипом не зависят от возраста матери.
Привычное невынашивание.
Под привычным невынашиванием понимают два и более выкидыша. В 50-80 % случаев выкидышей обнаруживают хромосомные аномалии. При привычном невынашивании доля эмбрионов с анеуплоидией еще выше. Проведение ПГС позволяет снизить частоту выкидышей, особенно в группе пациентов, где есть подтверждение анеуплоидии при предшествующих неудачных беременностях.
Повторные неудачи в ЭКО.
Под повторными неудачами в ЭКО обычно понимают 3 или более неудачных попыток ЭКО с переносом 4 и более эмбрионов высокого качества. Имеющиеся данные свидетельствуют о том, что эти пациенты имеет бОльшее количество эмбрионов с хромосомными аномалиями. Проведение ПГС может существенно увеличить вероятность успешного ЭКО. Но несмотря на успехи в диагностике хромосомных аномалий эмбрионов, остаются и другие причины повторных неудач, и далеко не все их них известны науке.
Наличие тяжелого мужского бесплодия
У мужчин с нарушением сперматогенеза выше вероятность того, что эмбрионы будут иметь хромосомные отклонения. У мужчин с нормальными показателями спермограммы среди сперматозоидов 3-8 % имеют хромосомные аномалии. В то же время, у мужчин с тяжелыми нарушениями сперматогенеза (маленькая концентрация, подвижность и низкое количество сперматозоидов с нормальным строением) наличие хромосомно аномальных сперматозоидов существенно увеличивается. Использование ИКСИ позволило преодолеть тяжелое мужское бесплодие и увеличило актуальность проведения ПГС у этих пар. При мужском бесплодии чаще обнаруживаются различные генетические дефекты. Они включают в себя анеуплоидии, чаще всего синдром Клайнфельтера, робертсоновские транслокаций, микроделеции Y-хромосомы, мутации рецептора к андрогенам, а также другие мутации (например, муковисцидоз, мутации трансмембранного гена-регулятора проводимости и гена глобулина, связывающего половые гормоны). Таким образом, высокий риск передачи генетических мутаций потомству пациента возникает в случаях необходимости проведения ЭКО с применением ИКСИ.
И все же делать ПГС, если нет «обычных» показаний, или не делать? Есть другие основания для ПГС?
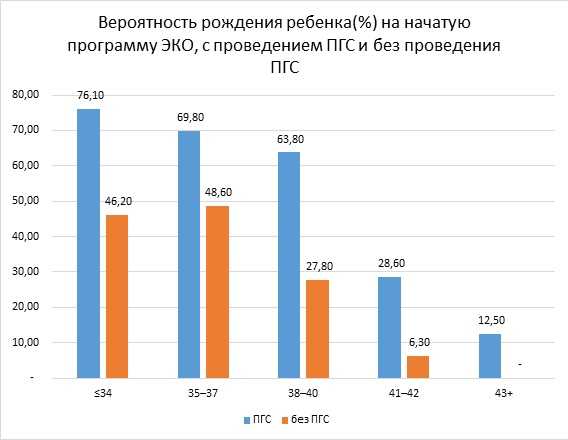
В августе 2016 года было опубликовано исследование, сравнивающее две стратегии:
Во всех возрастных группах наблюдается значимая разница по результативности. Но особенно в возрасте 38 и старше. Результативность на начатую программу ЭКО увеличивается в 2 и более раз. Заключение:Преимплантационная диагностика переросла в преимплантационный генетический скрининг (ПГС). По мере развития технологии ПГС из групп риска (те у кого выше вероятность эмбрионов с ненормальным кариотипом) начал давать положительный эффект в общей группе пациентов, обращающихся за лечением бесплодия с помощью ЭКО.
Исключение эмбрионов с отклонениями в кариотипе позволяет:
Чтобы все это получить важны:
Читайте также:
doctorvladimirov.ru Преимплантационная генетическая диагностика — ВикипедияПреимплантационная генетическая диагностика (ПГД) — диагностика генетических заболеваний у эмбриона человека перед имплантацией в слизистую оболочку матки, то есть до начала беременности. Обычно для анализа проводится биопсия одного бластомера у эмбриона, находящегося на стадии дробления (4-10 бластомеров). При материнском носительстве генетической патологии возможна биопсия 1-го и 2-го полярных телец яйцеклетки до оплодотворения. В последние годы наблюдается тенденция к переходу на биопсию трофэктодермы (внешнего слоя клеток) на стадии бластоцисты (пятый день развития эмбриона)[1]. Преимплантационная генетическая диагностика рассматривается в качестве способа альтернативного пренатальной диагностике. Его главное преимущество заключается в том, что при его использовании отсутствует селективное прерывание беременности, а вероятность рождения ребёнка без диагностируемого генетического заболевания достаточно высока. Таким образом, ПГД является дополнительной процедурой к вспомогательным репродуктивным технологиям и требует экстракорпорального оплодотворения (ЭКО). Идея проведения преимплантационной генетической диагностики появилась ещё до рождения первого ЭКО-ребёнка. В 1967 году была опубликована статья Р.Эдвардса (R. G. Edwards) и Р. Гарднера (R. L. Gardner) о проведении биопсии эмбрионов кролика для определения пола до имплантации, в которой авторы предсказывали появление аналогичных технологий у человека[2]. Однако преимплантационная генетическая диагностика у человека стала возможной лишь в начале 90-х годов, когда был достигнут достаточный технологический уровень экстракорпорального оплодотворения, а также разработана полимеразная цепная реакция, позволяющая проведение анализа ДНК в единичных клетках. В 1989 году проведена первая успешная попытка определения пола при помощи ПЦР-анализа бластомера, взятого у эмбриона на стадии дробления (6-8 бластомеров)[3]. Первые успешные роды после подобной процедуры у супружеских пар с риском по рецессивному Х-сцепленному заболеванию состоялись в 1990 году[4]. В 1990 году произведена диагностика моногенного заболевания до оплодотворения, методика включала ПЦР-анализ полярных телец яйцеклетки[5]. Первое рождение ребёнка после преимплантационной ПЦР-диагностики моногенного заболевания (муковисцидоза) состоялось в 1992 году[6]. В дальнейшем для определения пола эмбриона, а также хромосомных аномалий стали использовать метод флуоресцентной гибридизации in situ (FISH). Начиная с 2012 года, метод FISH для определения хромосомных аномалий постепенно вытесняется методом сравнительной геномной гибридизации. Метод ПЦР остался незаменимым для диагностики моногенных заболеваний. Показания для проведения преимплантационной диагностики[править | править код]Преимплантационная генетическая диагностика показана супружеским парам, у которых имеется носительство хромосомной перестройки или моногенного заболевания. Примерами моногенных заболеваний могут служить муковисцидоз, болезнь Тея — Сакса, серповидноклеточная анемия, гемофилия А, миодистрофия Дюшена и многие другие. Кроме этого, преимплантационная генетическая диагностика проводится у супружеских пар с повышенным риском врождённых аномалий у детей, который не связан с носительством диагностированных мутаций. К таким случаям относятся пары, где возраст матери превышает 35 лет; где возраст отца выше 39 лет; если у отца наблюдаются тяжёлые нарушения сперматогенеза; у супружеских пар с привычным невынашиванием; у супружеских пар с повторяющимися неудачными попытками ЭКО. В случае неопределённого повышенного риска рождения ребёнка с врождёнными аномалиями преимплантационная генетическая диагностика проводится для девяти хромосом, с которыми связаны наиболее часто встречающиеся врождённые заболевания. Это хромосома 13 (синдром Патау), хромосома 15 (синдром Прадера-Вилли), хромосома 16, хромосома 17, хромосома 18 (синдром Эдвардса), хромосома 21 (синдром Дауна), хромосома 22 (синдром «кошачьих зрачков»), а также половые хромосомы X и Y (различные численные аномалии, включая синдром Шерешевского — Тернера и синдром Кляйнфельтера). Преимплантационную генетическую диагностику проводят в некоторых случаях, не связанных с возможной генетической патологией плода, целью такой диагностики является рождение ребёнка с определёнными генетическими характеристиками. К таким случаям относится, например, преимплантационная генетическая диагностика, проводимая для предотвращения резус-конфликта. Существуют случаи, когда комбинируются несколько предпосылок к преимплантационной генетической диагностике. Одним из таких примеров является случай, когда при помощи преимплантационной генетической диагностики был рождён HLA-совместимый донор для клеточной терапии анемии Фанкони у пробанда[7]. В данном случае была исключена анемия Фанкони и был подобран нужный тип гистосовместимости. Проведение преимплантационной диагностики возможно только в рамках лечебного цикла ЭКО, а точнее экстракорпоральное оплодотворение с интраплазматической инъекцией сперматозоидов (ИКСИ), то есть сперматозоид вводят в яйцеклетку «вручную» с помощью микрохирургических инструментов. Процедура ИКСИ необходима в связи с тем, что при обычном ЭКО к яйцеклетке добавляется большое количество сперматозоидов. Затем, при заборе полярных телец или бластомеров, есть риск попадания в анализ вместе с клеткой эмбриона генетического материала сперматозоида, не участвовавшего в оплодотворении. Подготовка к лечебному циклу и сам лечебный цикл ЭКО с ПГД практически не отличается от обычного лечебного цикла ЭКО:
 Созревание яйцеклетки Созревание яйцеклетки Если генетическое нарушение наследуется от женщины, то можно отобрать «здоровые» эмбрионы, пройдя процедуру тестирования только полярных телец, не трогая сам эмбрион. Также можно протестировать только бластомеры. Либо может проводиться последовательное изучение полярных телец, затем бластомеров. Какая именно схема ПГД будет применяться для каждого конкретного случая, определяется на консультации с врачом-генетиком либо специально подготовленным ПГД-консультантом при планировании ПГД.
После оплодотворения яйцеклеток сперматозоидами в условиях эмбриологической лаборатории эмбрион развивается — клетки делятся. На третий день эмбрион состоит из 6-8 бластомеров. И на третий день происходит забор биологического материала для генетического исследования — так называемая «биопсия эмбрионов», то есть извлечение из эмбриона одного бластомера (а иногда также и полярных телец) с помощью специальных микроинструментов. Процедура не нарушает дальнейшего развития эмбриона. В то время пока выполняется генетическая диагностика, эмбрионы продолжают развиваться в соответствующей культуральной среде до переноса в полость матки на 5-е сутки развития. К этому времени эмбрион должен достичь стадии бластоцисты. Перед переносом эмбриолог оценивает строение и форму эмбрионов. Результат генетической диагностики сопоставляется с морфологией эмбрионов и делается заключение о том, какие эмбрионы рекомендуются для переноса в матку. Для переноса отбирают самые лучшие по морфологическим характеристикам эмбрионы без генетических нарушений. Анализ проводится в очень сжатые сроки. Для анализа бластомеров доступно всего 2 суток, так как эмбрион не может продолжать своё развитие вне организма матери далее стадии бластоцисты (5-е сутки после оплодотворения), поэтому исследование обязательно должно быть выполнено за это короткое время. Альтернативным подходом является проведение ПГД в криоцикле. В таком случае биопсия производится на 5 день развития, и сразу после неё эмбрионы подвергаются криоконсервации. В последующий месяц проводится генетическая диагностика и рекомендованные эмбрионы без мутаций переносятся в матку при следующем цикле. Практика разобщённого цикла имеет ряд преимуществ: меньший риск гиперстимуляции, большее количество материала и времени для анализа, менее травматичная для эмбриона процедура биопсии. Недостатком криоцикла является большее время от начала стимуляции до переноса эмбриона[1].
Метод флуоресцентной гибридизации in situ (FISH) — метод цитогенетического анализа, используемый для выявления и локализации специфических последовательностей ДНК на метафазных хромосомах и в интерфазных ядрах. В этом методе используются ДНК-зонды, которые представляют собой нуклеотидную последовательность ограниченного размера, комплементарную определённому участку ядерной ДНК. Зонд несёт «метку», то есть содержит нуклеотиды, связанные с флуорофором (молекулу, способную к флуоресценции). После процедуры гибридизации в случае образования гибридной молекулы ДНК-зонда и ДНК мишени на исследуемом цитогенетическом препарате можно наблюдать свечение специфических последовательностей ДНК на хромосомах или в ядрах при помощи флуоресцентного микроскопа. Полимеразная цепная реакция — это метод, основанный на многократном избирательном копировании определённого участка ДНК при помощи ферментов в искусственных условиях (in vitro). При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце. Преимущества преимплантационной диагностики[править | править код]
Риск при проведении преимплантационной диагностики[править | править код]
Возможность диагностики ещё до наступления беременности является главным преимуществом ПГД. Такая диагностика минимизирует риск того, что придется прервать развитие плода по генетическим причинам. Кроме того, в цикле ЭКО-ПГД получают обычно несколько эмбрионов, что позволяет выбрать эмбрион без генетического нарушения. Недостатками ПГД являются необходимость прохождения лечебного цикла ЭКО, достаточно высокая стоимость. Тем не менее, преимущества ПГД и опыт применения в разных клиниках во всем мире доказывают эффективность этой технологии. На сегодняшний день ПГД предоставляет пациентам с наследственной патологией альтернативный способ снизить риск беременности больным плодом и рождения ребёнка с генетическим заболеванием. Необходимо учитывать, что ПГД не может являться полной заменой пренатальной диагностики. В связи с тяжестью наследственной патологии, которая проверяется при ПГД и пренатальной диагностике, необходимо применить все методы исследования и подтверждающей диагностики, чтобы исключить генетический дефект. ru.wikipedia.org Предимплантационная генетическая диагностика (ПГС) - МоскваПреимплантационный генетический скрининг (ПГС) — это генетическое исследование эмбрионов, полученных в циклах ЭКО, которое позволяет выбрать эмбрионы без хромосомных аномалий для переноса в матку и повышает шансы на наступление благополучной беременности и рождение здорового ребенка.
Показания для проведения ПГС Качество эмбрионов и исход ЭКО напрямую зависят от качества ооцитов. Чем старше возраст женщины, тем ниже качество ооцитов. Поэтому генетический скрининг рекомендуется пациенткам старше 35 лет. Также показаниями для ПГС являются:
ПГС может проводиться по показаниям или по инициативе родителей, если они хотят снизить риск выкидыша, увеличить вероятность наступления беременности в результате ЭКО. Как проводится генетический скринингПГС — это исследование количества хромосом у эмбрионов, проводящееся при ЭКО перед переносом эмбрионов в матку. Перенос эмбрионов с отклонениями в числе хромосом (так называемых анеуплоидных эмбрионов) может привести к отсутствию имплантации, замиранию беременности или рождению ребенка с пороками развития. ПГС позволяет отобрать эмбрионы с нормальным количеством хромосом. Их перенос способствует наступлению и вынашиванию беременности, минимизирует риски рождения малыша с синдромом Дауна. Методы генетического скринингаВ клинике «Новая Жизнь» для генетического скрининга эмбрионов используется метод сравнительной геномной гибридизации (CGH). Это скрининг анеуплоидий по всем хромосомам – 2 половым (X и Y) и 22 парам соматических хромосом. Существуют различные методы получения генетического материала эмбриона для исследования, в клинике «Новая Жизнь» применяются биопсия бластомера и трофэктодермы. Бластомерная биопсия заключается во взятии у эмбриона одной либо двух клеток на третий день культивации. Эмбрион после этого возвращается обратно в культуральную среду и помещается в инкубатор, где он продолжает расти и развиваться, а полученные клетки используются для ПГС. Биопсия трофэктодермы выполняется на 5-6 сутки развития эмбриона, т.е. на стадии бластоцисты. Бластоциста состоит из двух типов клеток: клетки первого типа формируют сам плод, а клетки второго типа образуют наружный слой — трофэктодерму, из которой в дальнейшем образуется плацента. Именно клетки трафэктодермы берутся для дальнейшего генетического исследования, а клетки внутреннего слоя не затрагиваются. Безопасен ли генетический скрининг для эмбрионов?Поскольку генетический скрининг включает биопсию клеток эмбриона (т.е. их удаление), многих пациентов волнует вопрос — насколько это безопасно для дальнейшего развитии плода и уже родившегося ребенка? Согласно многочисленным исследованиям, а также данным Европейского общества репродукции человека и эмбриологии, биопсия эмбрионов не оказывает отрицательного влияния на здоровье детей, рожденных в результате ЭКО с ПГС. Кроме того, биопсия трофэктодермы не затрагивает клетки, из которых формируется плод, что делает этот метод получения материала для генетического скрининга максимально безопасным. Что дает диагностика ПГС?Меньше попыток для достижения положительного результата: ЭКО с ПГС, по сравнению со стандартным протоколом ЭКО, повышает вероятность успешной имплантации эмбриона и наступления беременности. Снижение риска выкидыша: около половины самопроизвольных абортов связаны с хромосомными аномалиями у плода. ПГС позволяет исключить вероятность переноса в матку эмбрионов с отклонениями в числе хромосом и снизить риск выкидыша на ранних сроках беременности. Повышение вероятности рождения здорового малыша: беременности с хромосомными отклонениями у плода ведут к рождению ребенка с серьезными пороками. С помощью ПГС врачи идентифицируют здоровые эмбрионы, лишенные хромосомных аномалий. Их перенос в матку в программе ЭКО позволяет добиться нормальной беременности и рождения здорового потомства. Преимплантационный генетический скрининг — современная и безопасная репродуктивная технология, доступная пациентам клиники «Новая Жизнь». Благодаря ЭКО с ПГС сотни пар стали счастливыми родителями здоровых малышей! Стоимость генетической диагностики (ПГС):Анализ CGH сравнительная геномная гибридизация Исследование 1 эмбриона 22 000 руб Биопсия бластомера или трофэктодермы 1-4 эмбриона 29 000 руб Биопсия бластомера или трофэктодермы 5 и более эмбрионов 32 000 руб
Дополнительная информация Популярные вопросы и ответы. ЭКОУважаемые читатели! Сегодня мы публикуем на нашем сайте очередную серию ответов на ваши самые популярные вопросы об ЭКО. Отвечает генеральный директор клиники, кандидат медицинских наук, врач высшей категории, Елена Игоревна Померанцева Как подготовиться к ЭКО?Кроме сдачи обязательных анализов и прохождения требуемых обследований, к процедуре необходимо подготовиться морально и всети правильный образ жизни. Сколько попыток может быть при ЭКОС каждым годом количество бездетных пар в России становится все больше. Сегодня эта цифра уже превышает 15% от общего числа семей. Но благодаря вспомогательным репродуктивным технологиям клиники Новая жизнь завести ребенка смогли уже 50 000 семей не только из России, но и по всему миру. Как проводят процедуру ЭКО?Основная задача врача перед началом стимуляции и получения биологического материала (у мужчины это сперматозоиды, у женщины яйцеклетки) тщательно обследовать пациентов и выявить причины, которые могут препятствовать положительному результату лечения. reprod.ru FAQ: Преимплантационный генетический скринингВ данном разделе приведены ответы на часто задаваемые вопросы об услугах Медико-генетического центра «Проген». Если вы не нашли ответ на свой вопрос, можете задать его нам «Онлайн» и мы обязательно ответим вам в ближайщее время. Что такое преидмплантационный генетический скрининг? Кому показан этот анализ? Предимплантационный генетический скрининг - это современный метод выявления хромосомных аномалий у эмбриона до переноса его в полость матки. Этот тест показан возрастным семейным парам, семьям с привычным невынашиванием, неудачными попытками ЭКО и супругам – носителям хромосомных перестроек. Чем отличается предимплантационный генетический скрининг от диагностики? Предимплантационный генетический скрининг направлен на исключение хромосомных нарушений у эмбриона, тогда как предимплантационная генетическая диагностика используется для определения моногенного заболевания или сбалансированной семейной транслокации у эмбриона. Данные исследования могут отличаться также методикой проведения. Что мне даст предимплантационный генетический скрининг? Предимплантационный генетический скрининг покажет молекулярный кариотип эмбрионов, планируемых к подсадке, специалисты проведут перенос здорового эмбриона, что снизит риск неразвивающейся беременности, связанный с хромосомными нарушениями, увеличит шанс успеха всей процедуры ЭКО и подарит Вам здорового малыша. Может ли предимплантационный генетический скрининг дать 100 % гарантию рождения здорового ребенка (без хромосомной патологии)? Точность метода очень высока и составляет 99,99%. Ни один из существующих методов не гарантирует 100%-ный результат, так как данная технология связана с малым количеством биоматериала. Кроме того, существует вероятность мозаицизма (разницы в количестве хромосом клеток трофоэктодермы и собственно эмбриона). Всегда после предимплантационного генетического скрининга рекомендуется проведение последующей пренатальной диагностики. Необходимо ли делать пренатальную инвазивную диагностику плода, если делали предимплантационный генетический скрининг? В случае выявления патологии при ультразвуковом исследовании плода и/ или высокого риска по биохимическому скринингу нужно обязательно провести инвазивное исследование, т.к. предимплантационный генетический скрининг не исключает мозацизма (разницы в количестве хромосом клеток трофоэктодермы и собственно эмбриона). Если при ультразвуковом исследовании не выявляется патология плода, то инвазивную пренатальную диагностику можно не проводить. Можно ли повредить эмбрионы при проведении предимплантационного генетического скрининга? Нет. На этой стадии развития эмбриона все его клетки полипотентны, т.е. не дифференцированы, и взятие такой клетки для исследования не вредит дальнейшему развитию эмбриона. Необходимо ли проведение предимплантационного генетического скрининга здоровым парам? Учитывая, что хромосомные аномалии могут случайно возникать независимо от здоровья супругов, желательно провести предимплантационный генетический скрининг для улучшения результативности ЭКО и вынашивания беременности, рождения здорового ребенка в семье. Мне 32 года, по кариотипу выявлена трисомия Х (47,ХХХ), муж здоров. Мы в браке 1 год, решили завести ребенка. Избавит ли его получения моей лишней хромосомы предимплантационный генетический скрининг? Действительно, предимплантационный генетический скрининг может определить патологию половых хромосом. Но, т.к. мы не исследуем половые клетки супругов, а проводим анализ эмбрионального материала, Вам следует учесть, что все тестируемые эмбрионы могут иметь дополнительную хромосому Х. Можно ли снизить риск невынашивания беременности, если проводить предимплантационный генетический скрининг? Конечно можно, ведь невынашивание беременности из-за хромосомных аномалий плода составляет 60%, и проведение предимплантационного генетического скрининга значительно (на 60%) снижает угрозу выкидыша. Недостатки и преимущества предимплантационного генетического скрининга? К преимуществам метода относится возможность диагностики почти всех видов хромосомных нарушений, за исключением сбалансированных транслокаций, возможность относительно быстрых сроков проведения исследования, увеличение результативности ЭКО и профилактика невынашивания при исключении хромосомных аномалий. К недостаткам, наверное, можно отнести стоимость исследования и невозможность определения перестроек, лежащих за пределами разрешающей способности метода. Можно ли определить пол ребенка при проведении этого скрининга? Предимплантационный генетический скрининг может определить патологию половых хромосом, актуальность же определения пола будущего ребенка зависит от наличия/ отсутствия заболеваний, сцепленных с полом, в конкретной семье. progen.ru ПГС: показания и преимуществаПоделиться в соц. сетях: 21-11-2017Одной из главных причин неудачных попыток ЭКО, самопроизвольного прерывания последующей беременности и рождения больных детей сегодня считается наличие хромосомных аномалий у плода. Избежать перечисленных рисков при ЭКО помогает преимплантационный генетический скрининг (ПГС), благодаря которому нарушения обнаруживаются еще на стадии получения эмбрионов, до их переноса в полость матки. Таким образом, для переноса используются только здоровые эмбрионы, благодаря чему многократно увеличиваются шансы на успешную беременность и рождение здорового малыша.  Хромосомные аномалии эмбрионов приводят к невынашиванию беременности Когда необходимо проведение ПГСПреимплантационный генетический скрининг не является обязательной процедурой и не входит в стоимость программы ЭКО, но в настоящее время специалисты все больше сходятся во мнении, что ПГС необходим как минимум в половине случаев ЭКО. На сегодняшний день показаниями к обязательному проведению ПГС являются:
Также ПГС оправдан при измененном кариотипе родителей, когда велик риск передачи наследственных патологий. В этом случае может быть показана и преимплантационная генетическая диагностика. Виды хромосомных нарушений и их последствияХромосомные аномалии эмбрионов носят название анеуплоидии. В норме у каждого человека имеется диплоидный или двойной набор хромосом в соматических клетках, который состоит из 22 пар аутосом и 2 половых хромосом. В половых клетках содержится гаплоидный или одинарный набор хромосом, который в момент оплодотворения становится диплоидным. Отсутствие одной хромосомы в любой хромосомной паре (моносомия) в большинстве случаев вызывает невозможность имплантации эмбриона или же приводит к внутриутробному развитию пороков, не совместимых с жизнью. При нехватке Х-хромосомы развивается синдром Шерешевского-Тернера, который проявляется аномалиями физического развития. Второй тип анеуплоидии – увеличение хромосомного набора на одну (трисомия), две (тетрасомия) или три (пентасомия) хромосомы. В большинстве случаев патология также несовместима с жизнью, но в ряде случаев приводит к нарушениям у плода. В частности, вызывает синдром Патау – тяжелые поражения мозга и внутренних органов, синдром Эдвардса – недоразвитие скелетной мускулатуры, деформации стоп и кистей, нарушения развития ЦНС и внутренних органов. 90–95 % случаев возникновения данных состояний приводят к гибели детей на первом году жизни. Наличие дополнительной Х-хромосомы у мальчиков вызывает синдром Кляйнфельтера с наличием разной степени выраженности умственной и физической отсталости, а также нарушениями полового развития. Одна из наиболее часто встречающихся патологий – синдром Дауна, который проявляется в умственной и физической отсталости. Преимущества преимплантационного генетического скринингаОсновное преимущество ПГС заключается в возможности отслеживания хромосомных нарушений у эмбриона еще до его переноса в матку, то есть до фактического наступления беременности. Другие методы диагностики, такие как пренатальный скрининг, позволяют обнаружить патологию только по факту, поэтому единственной мерой становится прерывание беременности.  Проведение ПГС в ряде случаев может ускорить наступление беременности методом ЭКО Использование ПГС в рамках проведения ЭКО повышает шансы на успешную беременность особенно у женщин в возрасте после 40 лет: вероятность успеха в этом случае практически такая же, как у молодой женщины. Главное – получить эмбрион с нормальным кариотипом. Довольно часто встречаются случаи, когда получить генетически здоровые эмбрионы не удается. Плюс ПГС опять же в том, что увидеть это можно заранее и принять решение о дальнейших действиях: использовании донорских яйцеклеток или же отказ от ЭКО в пользу усыновления. В настоящее время процедура ПГС хорошо знакома специалистам клиники «ЭКО на Петровке», которые имеют большой опыт в проведении данного исследования. Скрининг проводится путем биопсии, то есть забора нескольких клеток эмбриона на 5–6-е сутки его жизни. Данный метод является малотравматичным и полностью безопасным для эмбриона. Читайте также Метод лечения мужского бесплодия – ИКСИ Существуют разные варианты лечения тяжелых форм мужского бесплодия. Один из способов – ЭКО, который носит название ИКСИ, считается сегодня наиболее прогрессивным. Внематочная беременность после ЭКО Развитие плода вне полости матки – серьезное нарушение, которое достаточно трудно диагностировать. Оно угрожает жизни женщины и чревато серьезными осложнениями, вплоть до бесплодия. Сегодня мы подробно поговорим об этом явлении и назовем его основные симптомы. IVM: оплодотворение без гормонов В клинике «ЭКО на Петровке» проводится процедура ЭКО с IVM. Эта услуга – довольно новая в сфере вспомогательных репродуктивных технологий и сегодня проводится лишь в нескольких медицинских учреждениях столицы. «В сфере ЭКО мы во многом опережаем весь мир» В интервью врач-репродуктолог ЦМРМ «Петровские ворота» Виктор Александрович Владимиров отвечает на вопросы о том, как развиваются репродуктивные технологии, почему в России проще вылечить бесплодие, как родить ребенка, если 25 попыток ЭКО завершились неудачей. Сколько эмбрионов переносить: один или два? Каждая семья, планирующая ЭКО, сталкивается со множеством страхов и сомнений. Неудачное ЭКО Несмотря на стремительное развитие современных технологий в сфере репродуктологии ЭКО – не гарантия того, то беременность наступит с первого раза proivf.ru Скрининг при беременности - что это, когда делают и сколько стоит генетический скрининг беременных в клинике АльтравитаВ нашей стране обязательным является только ультразвуковое обследование. Анализ крови женщины сдают добровольно. Однако, если пациентка входит в группу риска, ей настоятельно рекомендуется прислушаться к мнению врача и пройти нужные тесты. Цели обследованияПроведение генетического скрининга перед беременностью преследует такие цели:
Основная задача скрининга первого триместра — выявить аномалии у плода, установить степень их тяжести, помочь родителям принять правильное решение по поводу дальнейшего вынашивания беременности и подготовиться к рождению особенного малыша Стоимость услуг Пренатальный комплекс 10-13 нед. (свободная b-субъединица хорионического гонадотропина человека (свободный b-ХГЧ, free b-hCG) Пренатальный комплекс 14-20 нед. (Хорионический гонадотропин человека (ХГЧ, бета-ХГЧ, б-ХГЧ, Human Chorionic gonadotropin, HCG) УЗИ беременной экспертное (одноплодная беременность до 14 нед.)включено допплерометрия, 3D и 4D УЗИ беременной экспертное + DVD (одноплодная беременность 15-36 нед.)включено допплерометрия, 3D и 4D Мы следим за актуальностью цен на сайте и делаем все необходимое, чтобы прайс-листы обновлялись регулярно. Для Вашего удобства мы размещаем перечень услуг с ценами. Чтобы узнать детальную информацию об услугах, звоните 8 (800) 551-99-03. Прайс-лист не является публичной офертой. Услуги оказываются только на основании заключенного договора. В нашей клинике принимаются к оплате пластиковые карты MasterCard, VISA, Maestro, МИР. Наши врачи Акушер-гинеколог, к.м.н Еличева Людмила Федоровна spetsialisty-kliniki/24-vrachi-kliniki-altravita/elicheva-lyudmila-fedorovna.html Врач акушер-гинеколог, к.м.н. /assets/content/images/doctors/elicheva.jpgг. Москва, ул. Нагорная, 4А от 1000 руб до 5 000 рубАкушер-гинеколог, к.м.н. Андамова Елена Викторовна spetsialisty-kliniki/24-vrachi-kliniki-altravita/andamova-elena-viktorovna.html Врач акушер-гинеколог, к.м.н /assets/content/images/doctors/andamova.jpgг. Москва, ул. Нагорная, 4А от 1000 руб до 5 000 руб Донов Всеволод Яковлевич spetsialisty-kliniki/24-vrachi-kliniki-altravita/donov-vsevolod-yakovlevich.html Врач УЗИ /assets/content/images/doctors/donov.jpgг. Москва, ул. Нагорная, 4А от 1000 руб до 5 000 руб Бабаянц Татьяна Александровна spetsialisty-kliniki/24-vrachi-kliniki-altravita/babayancz-tatyana-aleksandrovna.html Врач УЗИ /assets/content/images/doctors/babayancz.jpgг. Москва, ул. Нагорная, 4А от 1000 руб до 5 000 рубЗапишитесь на приём прямо сейчас altravita-ivf.ru Предимплантационный скрининг что это — Детки-конфеткиПГД (преимплантационная генетическая диагностика) – это обследование эмбриона на наследственные заболевания еще до переноса его в полость матки. ПГД проводится в рамках экстракорпорального оплодотворения. ПГД позволяет протестировать эмбрионы на определенные наследственные заболевания до переноса в полость матки при проведении процедуры ЭКО. В отличие от пренатальной диагностики ПГД не требует прерывания беременности для предотвращения рождения больного ребенка, т.к. проводится на этапе культивирования эмбрионов in vitro, до переноса в матку. Материалом для исследования могут служить полярные тельца, бластомеры и клетки трофэктодермы эмбриона. Организация ПГД – это комплексный процесс, требующий координации работы многих специалистов: врачей репродуктологов, эмбриологов, генетиков, а также служб, обеспечивающих пересылку биоматериалов. ПГД выполняется в четко ограниченные срок, т.к. эмбрион не может развиваться вне организма матери больше 6 дней и должен быть либо перенесен в матку, либо криоконсервирован в конце этого срока. Биопсийный материал является уникальным и не может быть взят повторно. ПГД: диагностика моногенных заболеваний В настоящее время в мире живет 350 млн людей, страдающих редкими заболеваниями. Около 80% таких заболеваний имеют генетическую природу. Например, в Европе больные наследственными заболеваниями составляют около 6% популяции. В таких семьях в случае, если выявлена мутация гена, послужившая причиной развития наследственного заболевания, возможно проведение ПГД. ПГД позволяет проводить эффективную профилактику наследования эмбрионом моногенного заболевания. Семья, знающая о риску рождения ребенка с генетическим заболеванием, благодаря ПГД получает возможность родить здорового ребенка. Арсенал методов, используемых в генетической лаборатории позволяет проводить ПГД большинства известных моногенных наследственных заболеваний, среди которых:
Показания для проведения ПГД моногенных заболеваний:
ПГД: диагностика хромосомных заболеваний По данным ВОЗ риск женщины родить ребенка с трисомией составляет 1/385 в возрасте 30 лет, 1/63 – 40 лет и 1/19 – в 45 лет. При этом встречаемость летальных хромосомных аномалий, приводящих к внутриутробной смерти плода еще больше. При обследовании женщин, проходящих лечение бесплодия в центрах ЭКО было установлено, что число эуплоидных (имеющих нормальный набор хромосом) эмбрионов у пациенток старше 42 лет не превышает 22%. Эффективным способом снижения риска спонтанных абортов, а также уменьшения числа неудачных попыток ЭКО является ПГД на хромосомные аномалии. Показания для проведения ПГД хромосомных аномалий по 46 хромосомам:
Актуальность ПГД С возрастом в яйцеклетках и сперматозоидах происходят генетические изменения, которые приводят к замершим беременностям, привычному невынашиванию и снижению шансов забеременеть. ПГД отбирает только здоровые, без генетических изменений эмбрионы. Благодаря этому значительно повышается результативность цикла ЭКО, снижается вероятность рождения ребенка с хромосомными аномалиями, а также ри deti.medicalfirst.ru |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||